急性大動脈解離は致命的な救急疾患の代表ですが、症状が多彩で非侵襲的な検査では除外が困難な病気です。
これといった決め手に欠けて、見逃しやすい病気です。
実際に過去の報告でも、急性の大動脈疾患の見逃し率は14~39%と高率であると報告されています。
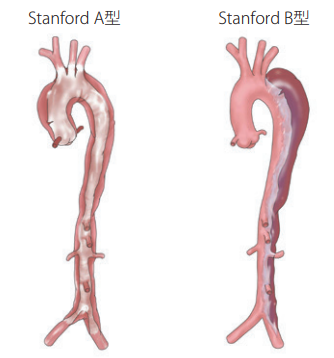
見逃しやすい一方で、特にStanford A型の大動脈解離は死亡率が高いです。
緊急手術をしても死亡率は10%程度、1時間遅れるごとに死亡率は2%上昇、院外発症のA型解離による心肺停止は死亡率100%と凄いことが書かれています。
そもそも病院外死亡が多くて、実際の死亡率はブラックボックスなところがあり“幸運にも病院に辿り着けた人でも死亡率が高い”という印象です。
“裂けるような痛み”や“移動する痛み”はよく耳にする典型的な症状と思いますが、症状は主観的であり、正直なところ参考にしかなりません。
ガイドラインではDダイマーを否定目的で使うな、と記載がありますし、血圧の左右差やX線も決定打になりません。
心エコーでフラップを見つけるというのも非専門医には困難だと思います。
そもそも、経験上きれいにフラップが見えることはありません。
なぜ見逃しやすいから注意と言われ続けるのか。
私は検査の項目1つや2つで簡単に判別できる病気ではないので、経験無しで教科書だけ読んでも会得できないものだからと思っています。
いわゆる総合的な判断という分かったような分からないような話です。
それでも経験上、注目すべきポイントはあると思いますので、今日は、この大動脈解離について、自身の経験を交えて話そうと思います。
症例
50代の女性、強い胸痛・苦悶様で心電図変化はないものの、ACSについて評価をお願いしますと私へコンサルトがあった症例がありました。
患者さんを診て一目で思ったことは、普段見ている急性心筋梗塞とは異なる、異様な痛がり方と冷汗です。
心エコーでは壁運動異常なし、上行大動脈が少し拡大して大動脈弁の接合が悪いように見え、少し大動脈弁の逆流(AR)を認めたことから、採血や他の検査を待つことなく、すぐさま造影CTへ行きました。
すると、案の定、Stanford A型の大動脈解離でした。上行大動脈で裂けています。
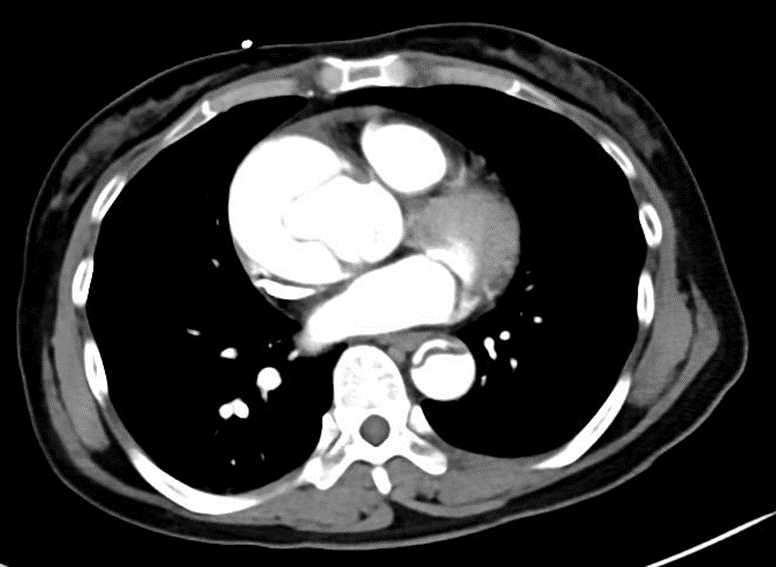
すぐにCT室から心臓外科医に連絡しました。
CTの撮影時点では心嚢液はなく、救急外来に戻って心臓外科の先生に引き継ぎをして、さらに詳細に心エコーを確認しましたが、左室の動きは良く、ARも少ししかなく、心嚢液もありませんでした。
この時点で「自分の仕事は終わった」と思って立ち去る人も多いかと思います。
しかし、心臓外科の先生はあちこち駆け回って手術室、麻酔科、他の心臓外科医と連絡をしており、家族へ沢山ある同意書を説明する必要があります。
患者を誰も見ていないのは好ましくないため、私は急変に備えてずっとベッドサイドに立っておりました。
患者さんに定期的に声かけもしていましたが、ある時、急に反応が悪くなってきました。
モニターのアラームは何も鳴っていません。
しかし、呼びかけに反応がありません。脈も触れません。
「挿管準備して!」
と大声で叫び、救急外来にいる医師や看護師を集めました。
モニター心電図ではST変化がなかったので、心エコーを確認すると1-2cmほどの心嚢液を認め右房が虚脱…
心タンポナーデの所見です。
こうなるとドレナージが必須なので、研修医に胸骨圧迫をしてもらいながら私は急いで準備です。
幸いにもERにはベテランの救急医がいたことから挿管や他の指示を任せることが出来、私は手技に集中しました。
心エコーで深さを確認、麻酔はせずに針をすすめ、固い心膜の抵抗と弾力を感じたところで、ゆっくりと更に力を加えます。
うにゅっ、と貫く感覚がしたところで力を緩めてシリンジを引くと、血液そのものが引けました。
ワイヤーを入れて、エコーでワイヤーが心嚢内にあることを確認して、ドレーンを挿入し、手動で血液を少しずつ引き、しばらくすると脈を触れるように。
解離のタンポナーデでは血液は際限なく引けてしまうので、血圧が出たところでドレナージは一旦やめ、脈を触り続けます。
脈の触れが弱くなったら、また少し血液を引いて、脈を触って、と繰り返し、何とか手術室まで辿り着くことができました。
ここからは麻酔科の管理と手術なので、自分の仕事はここで終了と思い、立ち去ることにしました。
どうやって大動脈解離を疑うのか
まず、循環器学会のガイドラインからフローチャートを引用してみます。
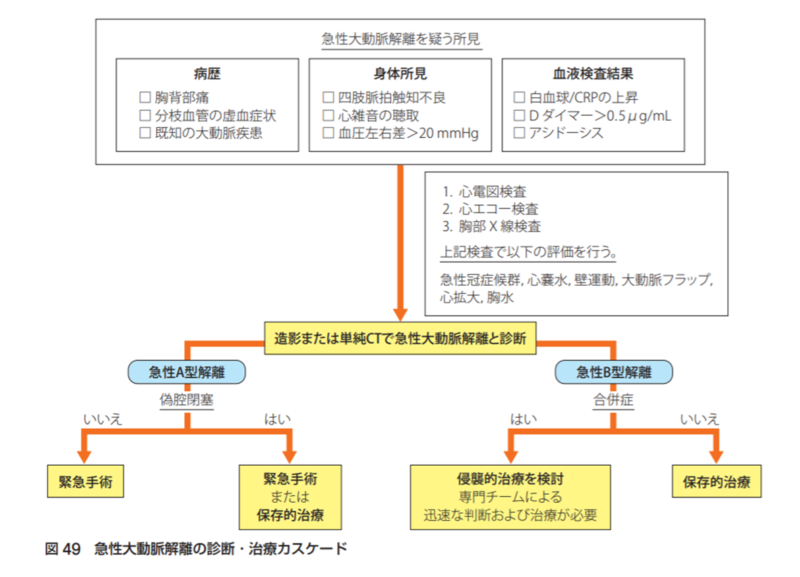
全体的な流れはわかりやすいものの、肝心の造影CTをどんな人に撮影すれば良いのか、指標ははっきりしません。
欧米のガイドラインでは、Aortic Dissection Ditection Risk Score(ADD-RS)とDダイマーを組み合わせて評価が提案されています。簡単にまとめると、このような感じになります。

とはいえ、“激しい”とか”突然の”という主観的な項目が含まれており、結局のところ診療した医師がこの痛みの特徴の項目の1点を取るか取らないかで大きく方針が変わってしまいそうです。
新規の拡張期雑音と言われましても、初めて見る方では新規かどうかわかりませんし。
さらにこの研究は他の集団での検証が不十分なので、完全に信頼しきることは危険です。
心エコーでの評価は、経験上は、綺麗にフラップが見えることはなく、偽腔が張って真腔が潰されることが多いためフラップは大動脈壁に張り付いたような感じになり、動脈硬化のアーティファクトと判別しがたいです。
これらを踏まえた上で、個人的に大動脈解離を疑うキーポイントは、
- 心筋梗塞とは違う異様な苦しがり方や重篤感
- 上行大動脈の形状の違和感(不自然な拡大、変な向きのARなど)
の2つなのですが、いずれも医師の側からの主観的の判断です。個人的な意見ですみません。
しかし、1つの検査や診察所見で判断できない以上、総合的な判断を要するわけです。
この辺りは、明確な基準で分けて考えるエビデンスには現れにくい、“医師の目”だと思います。
特にA型解離は、異様としか表現できないような人たちが多いです。
まさに瀕死の状態なわけで、疼痛も強烈なものだと思いますので、”生命の危機”という感じをヒシヒシと感じます。
では、見慣れていない人はどうするべきでしょうか?
結局のところ、造影CTを撮影するかどうかが鍵です。
単純CTでは専門家がみても1割弱見逃します。造影CTをとれば基本的には見逃さないはずです。
とにかく疑ったら造影CTです。
見逃さないようにするには、それしかありません。
では、全例で造影CTするの…?
そんなわけにはいきませんよね。
そこで上述のADD-RSは1つの指標になり、CTを撮影しない理由になります。
Dダイマー単独での除外よりは根拠があります。
残念ながら見逃しは出てしまうので盲信は出来ませんが…
診断後は絶対に目を離してはいけない
無事に急性大動脈解離Stanford A型と診断すると、心臓外科にコンサルトし緊急手術について考える必要があります。
外科の先生を呼んで、引き継ぎをして、一段落と思っていませんか?
心臓外科の先生が緊急手術が必要と判断すると、家族への説明、手術室の手配、麻酔科医や他の心臓外科医の連絡などで患者の側にいる時間は少ないです。
この間に急変する可能性があるのが、Stanford A型の大動脈解離です。
- 心タンポナーデ
- 心筋梗塞
- 急性の大動脈弁閉鎖不全症
この三つは国家試験でも頻出の重大な合併症ですが、知っていても、現場で生かせなければ意味がありません。
急性心筋梗塞を併発した場合、基本的にはモニターの心電図で判断できます。
Ⅱ誘導かⅢ誘導を表示させることが多いと思いますが、右冠動脈が閉塞した場合はST上昇、反対に左冠動脈が閉塞した場合は主幹部病変なので対側変化でSTが低下します。
大動脈解離では基本的には冠動脈の入り口をふさぐだけなので、分かりやすいですね。
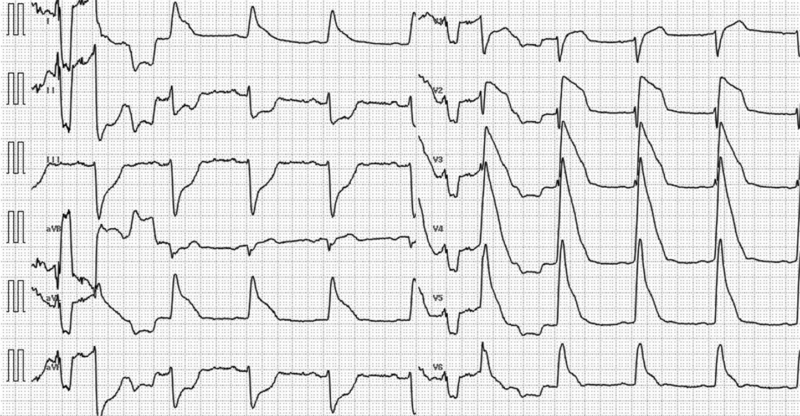
さて、心タンポナーデはどうやって気づくでしょう?
ずっと心エコーを当て続けるわけにもいきません。
A-lineを挿入する前だと、マンシェットでの血圧測定ではインターバルがありますから、血圧低下はすぐに察知できないと思います。
降圧目的でニカルジピンを使うことも多いでしょうから、「効きすぎちゃったかな?」と悠長に構えていると手遅れになります。
どうするのかというと、患者から目を離さないのです。
心タンポナーデを起こすと、患者さんは静かに心肺停止になります。
カルテに向かい合っている場合ではありません。心電図は正常ですし、血圧やSpO2のモニターは遅れて変化が出てくる、急変から感知するまでにタイムラグがあるので、アラーム音が鳴ってからでは手遅れの可能性があります。
死亡率が高い病気であることは有名だと思いますが、実際に診断してから手術室に行くまでの30分の間に急変を経験するケースは沢山あります。
私自身、そのような経験をしたことから、自分で診断をつけて心臓外科の先生を読んだ後には、出棟までの間にA-line挿入や降圧はこちらで管理しますよ、と提案しつつ、必ず患者のそばに居続けます。
コンサルト後の対応は、あまり教科書には書いていないですが、とにかく目を離してはいけない病気だと思います。
急性心筋梗塞を診断したが大動脈解離が隠れていないかどうか不安・・・
上述のように、大動脈解離を完全に否定するには造影CTしかありません。
急性心筋梗塞を診断したときに、実はこれが急性大動脈解離が原因で起こっているのではないかという不安はつねに付きまといます。
心エコーで、例えば前壁中隔の中間部から心尖部に壁運動低下があるなど、冠動脈の途中で閉塞が疑われる症例は、大動脈解離の可能性は、かなり低いと思います。
しかし、右冠動脈の梗塞や、左主管部病変の疑いだと・・・
実際のところ、急性心筋梗塞の中に、大動脈解離が紛れている頻度は、報告によってばらつきがありますが、1000人~2000人に1人程度です。
特にST上昇型の心筋梗塞では再灌流までの時間が重要であり、全例でCTを撮影する余裕はありませんし、アスピリンも早々に噛ませるべきです。
上述のADD-RSを評価して、大動脈解離の可能性があれば造影CTを先行するというのは、一つの指標になりそうです。
個人的には腹部の聴診を勧めます。
学生時代、OSCEで習得するものの現場でおなかの血管の聴診をする人はかなり少ないのではないでしょうか?
大動脈解離では診断の補助になることがあります。
しばしば横隔膜付近にre-entryをつくり、雑音が聞こえます。
心筋梗塞の機械的合併症の評価で胸部聴診は行うはずですから、そのまま心窩部に当てて押し付けると、腎動脈狭窄症の有無や、圧痛から胃潰瘍を疑うなど情報量が多いと思います。
とはいえ実際のところ、緊急冠動脈造影をして、
- カテーテルが冠動脈にかからない=偽腔に入っている
- 狭窄の仕方がいびつ=偽腔で圧排されている
など解離を疑う所見に後から気づくことは稀にあります。
残念ながら循環器内科をやっていても、初診時の所見だけで全て一発診断は困難なのです。
しかし診療の途中で気づいて診断に至ることも大事ですので、常に意識をしておく必要はあると思います。
まとめ
大動脈解離、特にStanford A型について話しました。
多くの症例でインパクト強めなので、循環器内科をやっていると思い出話が沢山出てきます。
教科書の内容だけでは理解しがたい病気と思いましたので、個人的な経験も踏まえて書きましたが、皆様の参考になれば幸いです。
最後まで読んでいただき、ありがとうございました。
◆参考文献
2020 年改訂版 大動脈瘤・大動脈解離診療ガイドラインより引用
いつもの循環器学会のガイドラインです。オンラインで無料で閲覧できるのは、とてもありがたいです。
Thierry Carrel et al. Acute aortic dissection. Lancet. 2023 Jan 11;S0140-6736(22)01970-5.
最近、ランセットに大動脈解離についての論文が出ました。ADD-RSを含めた診断のフローチャートがあり、STEMIの時にもエコーやADD-RS評価と記載があります。英語ですがフローチャートだけでも是非。
Diagnostic Accuracy of the Aortic Dissection Detection Risk Score Plus D-Dimer for Acute Aortic Syndromes: The ADvISED Prospective Multicenter Study. Circulation. 2018 Jan 16;137(3):250-258.
ADD-RSについての論文です。大動脈疾患の見逃しは多いため、ADD-RSとDダイマーを組み合わせて判断すると良いとする報告です。
ただし本文中にも述べましたが、他の集団での検証が不十分なので、本当に使える指標かどうかは今後の研究待ちですね。



コメント